カテゴリー:感染症とCOVID-19 (2022年〜)
2022.03.09更新
はじめに
もう2年近く前になりますが、私はCOVID-19ワクチンに対する期待と懸念を寄せるブログ記事を書きました(→集団免疫とワクチンーCOVID-19抑制へ向けての潮流)。期待はもちろんゲームチェンジャーとして機能するワクチンの登場であり、懸念は安全性に関することです。とくに当時から注目され、期待されていたmRNAワクチンについては、技術的に克服すべき面が多いことを指摘した上で、レトロトランスポジション(レトロポジション)による逆転写や宿主DNAへの組み込みがないことを確かめておくべきと述べました。
現在、日本を含めた世界各国で、ワクチン接種プログラムが進められ、そのなかでもファイザー/ビオンテックのmRNAワクチンBNT162b2が主流となっています。ワクチン推しの国や医療専門家は、「ヒトには逆転写活性がないのでワクチン-mRNAが宿主DNAに組み込まれることはない」と異口同音に言ってきました。しかし、厳密に言えば逆転写がないとすることは間違いであることを、私はこのブログ上でもSNS上でも何度も指摘してきました。
また、SARS-CoV-2のRNAがレトロポジションでヒトのDNA中に組み込まれることも論文で報告されました [1]。このDNAへの組み込みには、ヒト内在性逆転写酵素である長鎖散在反復配列(Long Interspersed Nuclear Element-1、LINE-1)が関与しています。この結果から、ますますワクチンmRNAがDNAに統合される可能性がないか、調べる必要があると指摘しました(→新型コロナウイルスのRNAがヒトのDNAに組み込まれる)、SARS-CoV-2の遺伝子がヒトDNAと組み込まれることを裏付ける新たな証拠、ヒトのゲノムに組み込まれる?、mRNAワクチン接種は実験的遺伝子治療?)。
今回、スウェーデンの研究チームが、予備的な知見ではありますが、ワクチンmRNAのレトロポジションに繋がるような重要な研究結果を報告しました [2]。発表された論文は、COVID-19ワクチンBNT162b2のmRNAのヒト肝細胞への影響に関する初の in vitro 研究を報告したものであり、BNT162b2-mRNAの細胞内への迅速な侵入と、その後のmRNAのDNAへの細胞内逆転写が起こることを示しています。
このブログでこの論文を紹介したいと思います。まずは以下に論文のアブストラクトを全翻訳して示します。
Intracellular reverse transcription of Pfizer BioNTechCOVID-19 mRNA vaccine BNT162b2 in vitro in human liver cell 1ine by Aldén, M. et al. [2].
------------------
ファイザー社とバイオテック社が開発したCOVID-19 mRNAワクチンBNT162b2の前臨床試験では、ワクチン注射を受けた動物に可逆的な肝機能の影響が認められた。さらに、最近の研究では、SARS-CoV-2 RNAが逆転写され、ヒト細胞のゲノムに統合されることが示された。本研究では,BNT162b2がヒト肝細胞株Huh7に及ぼす影響をin vitroで検討した。 Huh7細胞をBNT162b2に暴露し、細胞から抽出したRNAに対して定量PCRを行った。その結果、Huh7細胞においてBNT162b2が高レベルで検出され、内因性逆転写酵素であるlong interspersed nuclear element-1(LINE-1)の遺伝子発現が変化していることが確認された。BNT162b2を投与したHuh7細胞において、LINE-1 open reading frame-1 RNA-binding protein(ORFp1)に結合する抗体を用いた免疫組織化学的解析により、LINE-1の核内分布が増加することが示された。BNT162b2で処理したHuh7細胞のゲノムDNAをPCRしたところ、BNT162b2特有のDNA配列が増幅された。この結果は、BNT162b2がヒト肝細胞Huh7に速やかに取り込まれ、LINE-1の発現と分布が変化することを示している。また、BNT162b2のmRNAは、BNT162b2曝露後、わずか6時間で細胞内でDNAに逆転写されることも明らかにした。
------------------
以上です。
2. 研究の背景
まずは、論文を適宜翻訳、要約しながら、研究の背景を記します。
COVID-19のワクチンはいくつか開発されていますが、特にファイザー社とビオンテック社が開発したmRNAワクチンBNT162b2が臨床試験で評価され、世界各地でCOVID-19国家予防接種プログラムが進められています。BNT162b2は、脂質ナノ粒子(LNP)でカプセル化したヌクレオシド修飾RNAワクチン(modRNA)です。SARS-CoV-2スパイクタンパク質全長をコードし、抗原的に最適な融合前コンフォメーションを確保するために2つのプロリン変異で修飾されており、ウイルス中和抗体を誘発させます。
BNT162b2は、無作為化臨床試験と同様に、実用化に際して高い有効性を示しています。 しかしながら、ワクチンの長期的な安全性と有効性のモニタリングなど、多くの課題が残されており、この面での評価と調査が必要です。とくに、BNT162b2の安全性プロファイルは、現在、短期間の臨床試験からしか得られておらず、ほとんど不明なままです。
従来のワクチンと比べて、mRNAワクチンは高頻度の副作用(side effects)を発生させています。そのなかで、BNT162b2ワクチンによる一般的でない副作用として、心筋炎・心膜炎、不整脈、深部静脈血栓症、肺塞栓症、心筋梗塞、頭蓋内出血、血小板減少症など、多くの症例が報告されています。 mRNAワクチンに関連する副作用のメカニズムをより良く理解するためには、臨床研究だけでなく、細胞や分子レベルにおける研究が必須です。
最近の研究では、SARS-CoV-2のRNAが逆転写され、ヒト細胞のゲノムに統合されることが示されました [1]。これにはLINE-1によるレトロポジションによるものです。このことは、SARS-CoV-2のスパイクタンパクをコードするBNT162b2でも起こりうるかどうかという疑問を生じさせます。
ファイザー社が欧州医薬品庁(EMA)に提供した薬物動態試験データでは、放射性標識したLNPとルシフェラーゼmodRNAをマウスとラットに筋肉内注射することで、BNT162b2の生体内分布が調べられています [3]。このデータでは、最初の時間点(0.25 時間)からほとんどの組織で放射性活性が検出されています(注射部位と肝臓が主な分布部位)。さらに,BNT162b2 の注射を受けた動物では、肝臓の肥大、空胞化、γGT(γglutamyl transferase)値の上昇、AST(aspartate transaminase)値および ALP(Alkaline phosphatase)値の上昇などの可逆的肝影響が観察されています 。
LNP送達システムによって引き起こされる一過性の肝障害は、以前に報告されています。それにもかかわらず、modRNAを含まない空のLNPだけでは、重大な肝障害を引き起こさないことも示されています。
そこで、研究チームは、BNT162b2のヒト肝細胞株への影響をin vitroで調べ、そのmRNAが内因性メカニズムによってDNAに逆転写されるかどうかを確かめることを目的として、主にPCRと免疫組織学的染色という簡単な技法を用いて、その証明に挑戦しました。
2. 研究の概要
論文を翻訳、要約しながら以下に示します。
2-1. ワクチンmRNAはヒト肝細胞Huh7に高い効率で侵入する
本研究では、まず、ヒト肝臓がん由来の細胞株である"Huh7"を使って、BNT162b2-mRNAが侵入するかどうかを調べました。Huh7細胞におけるLNP送達の取り込み動態に関する先行研究では,LNPの最大生物学的効果は4-7時間の間に観察されています。そこで本研究では、Huh7細胞を高濃度のBNT162b2-mRNA(0.5、1.0および2.0 μg/mL)とともに6、24、および48時間培養しました。コントロールとしてmRNAを添加しない培養を用いました。
培養細胞からRNAを抽出し、BNT162b2配列を標的とするプライマーを用いて、逆転写リアルタイム定量PCR(RT-qPCR)を行ないました。PCRプライマー設計のために、BNT162b2の塩基配列を詳細に解析した結果、ヒトゲノム配列と100%同一の配列が124個、19〜26ntsに1塩基(nt)のみミスマッチのある配列が3個ありました。 そこで、ヒトゲノム領域と非特異的に結合せずに、BNT162b2特有のPCRアンプリコン(444 bp)を検出できるようなプライマーを設計しました(図1)。すなわち、SARS-CoV-2のSタンパク質領域を標的とするフォワードプライマー、3′-UTRを標的とするリバースプライマーを用いました。

図1. BNT162b2の一次構造とPCR増幅位置(文献 [2] より転載). BNT162b2の概要と構成: ヒトα-グロビン遺伝子の5′-UTRを組み込んだ2ヌクレオチドのキャップ、5′-非翻訳領域(UTR)、SARS-CoV-2のSタンパク質全長と2つのプロリン変異、ヒトミトコンドリア12S rRNA(mtRNR1)セグメントとヒトAES/TLE5遺伝子セグメントと2つのC→U変異、ポリ(A)テールを含む3′-UTR.
RT-qPCRの結果、BNT162b2で処理したHuh7細胞は、6、24、48時間後にハウスキーピング遺伝子に比較して高レベルのBNT162b2-mRNAを示しました。BNT162b2-mRNA レベルは、6 時間後に比べて 24 時間後に有意に減少するものの、48時間後には再び増加しました。
2-2. LINE-1に対するBNT162b2の影響
研究チームは、BNT162b2がLINE-1遺伝子発現に及ぼす影響について検討しました。 BNT162b2-mRNA (0〜2.0 μg/mL) で6、24、48時間処理したHuh7細胞からRNAを抽出し、LINE-1を標的にしたプライマーを用いてRT-qPCRを行ないました。その結果、BNT162b2がLINE-1遺伝子発現に影響を及ぼすことがわかりました。BNT162b2濃度 2.0 μg/mL により、6時間後にコントロールと比較して有意にLINE-1発現が増加しました。より低いBNT162b2濃度ではすべての時点でLINE-1発現が減少しました。
次に、BNT162b2がLINE-1タンパク質の量に及ぼす影響を免疫組織化学的に調べました。 LINE-1は、5′UTR、ORF1とORF2の2つのオープンリーディングフレーム、3′UTRからなり、そのうちORF1はシャペロン作用を持つRNA結合タンパク質です。先行研究で、LINE-1のレトロポジション活性は、ORF1の核への移行が関与していることが示されています。そこで、BNT162b2 (0.5〜2.0 μg/mL) で6時間処理したHuh7細胞を固定し、LINE-1ORF1pに結合する抗体を用いた免疫染色を行ない、細胞核をHoechstで染色しました。
LINE-1タンパク質の核内移行は、レトロポジションと関連していることが先行研究で示されています [4]。今回の免疫蛍光染色の結果は、BNT162b2の濃度が最も低い場合(0.5μg/mL)でも、すでに核内のLINE-1のレベルが上昇していることが確認されました(図2)。
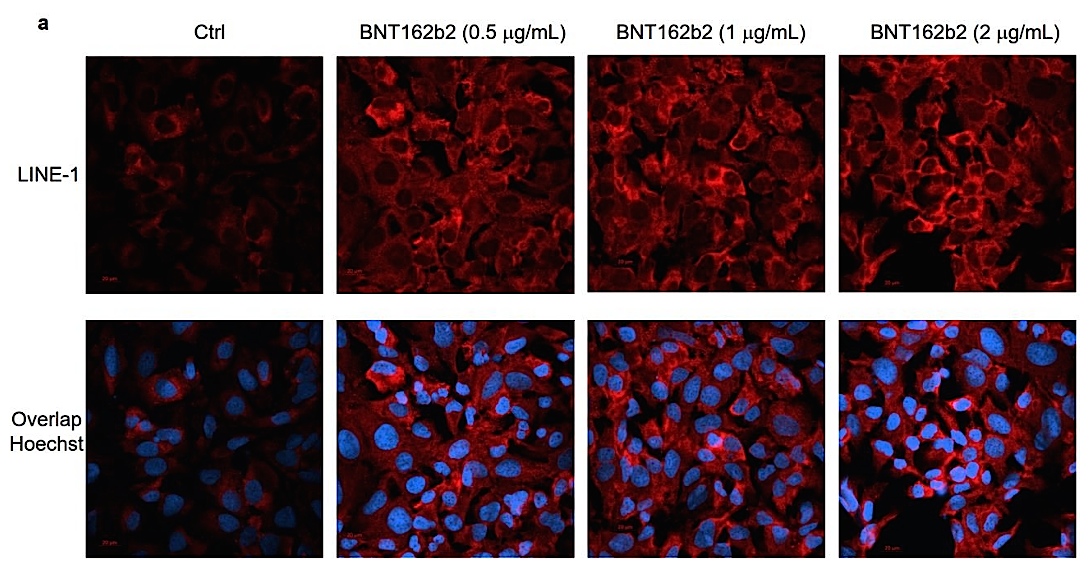

図2. BNT162b2で処理したHuh7細胞のLINE-1タンパク質分布に関する免疫組織化学的解析(文献 [2] より転載). Huh7細胞を6時間無処理(Ctrl)およびBNT162b2濃度0.5、1、および2μg/mL処理した後、細胞を固定し、LINE-1 ORF1pと結合する抗体(赤)および細胞核の可視化のためのDNAプローブHoechst(青)で染色. (a) BNT162b2で処理した、または無処理のHuh7細胞におけるLINE-1発現の代表的な画像. (b-d) 細胞全体 (b)、細胞質 (c)、核 (d) におけるLINE-1タンパク質の定量化. データは平均値±SDで示す (**p< 0.01; ***p< 0.001;****p< 0.0001).
BNT162b2-mRNAがLINE-1上昇時にDNAに逆転写されるかどうかを調べるために、BNT162b2で処理したHuh7細胞からゲノムDNAを精製し、RNase処理でRNAを除去し、BNT162b2標的プライマーでPCRを行いました。その結果、BNT162b2のDNAアンプリコンは、ゲル電気泳動において、3つのタイムポイント(6、24、48時間)すべてで検出されました(図3)。そして、サンガーシークエンスにより、このDNAアンプリコンはプライマーに挟まれたBNT162b2配列と同一であることが確認されました。

図3. NT162b2で処理したHuh7細胞におけるBNT162b2のDNA増幅物(444 bp)のアガロースゲル電気泳動による検出(文献 [2] より転載). ゲノムDNAを精製し、100μg/mLのRNaseで処理し、BNT162b2を標的とするプライマーを用いて、PCR増幅. L, DNA ladder; BNT, BNT162b2, Ctrl1, 培養Huh7細胞; Ctrl2, 培養6時間後に回収した無処理のHuh7細胞;Ctrl3, 培養24時間後に回収した無処理のHuh7細胞; Ctrl4, 培養48時間後に回収した無処理のHuh7細胞、Ctrl5:BNT162b2濃度0.5μg/mLで6時間処理したHuh7細胞からのRNA; Ctrl6, BNT162b2濃度0.5μg/mLで6時間処理したHuh7細胞からのRNA(RNAase処理).
さらに、得られたDNAアンプリコンがBNT162b2-mRNAではなくDNAに由来することを確認するために、0.5μg/mL BNT162b2で6時間処理したHuh7細胞から精製したRNAについても、RNase処理あり/なしでPCRを行いました。その結果、RNAからはアンプリコンは得られませんでした。
3. 考察と意義
本研究の成果は、予備的な知見ではありますが、三つの点で意義があると思います。一つは肝細胞をmRNAワクチンにさらすと、容易に細胞内に侵入すること、二つ目はその侵入がLINE-1の発現を促進すること、そして三つ目は侵入したワクチンmRNAがDNAに逆転写されることです。以下、LINE-1の発現とワクチンmRNAの逆転写に注目しながら、論文の考察部分を翻訳しながら、要約します。
ヒトゲノムの約17%はLINE-1配列で構成されています。これは、細胞内在性逆転写酵素であり、ヒトに唯一残る活性型トランスポゾンで、自身と他の非自律型要素をゲノム上の別の位置に転位させることができます。非自律的なAlu要素、short, interspersed nucleotide element (SINEs)、variable-number-of-tandem-repeats (VNTR) や細胞内のmRNA処理された偽遺伝子は、トランスで働くLINE-1逆翻訳タンパク質によって逆翻訳さます。最近の研究では、内在性のLINE-1がSARS-CoV-2配列の逆転写と感染ヒト細胞のゲノムへの組み込みを媒介することが示されています。
さらに、内因性LINE-1の発現は、SARS-CoV-2感染を含むRNAウイルスやレトロウイルス感染時にしばしば増加することがわかっています [5, 6, 7]。 LINE-1のレトロポジション活性は、RNA代謝、DNA損傷応答、オートファジーによって制御されていることがこれまでの研究で明らかにされています。LINE-1の効率的なレトロポジションは,細胞周期や有糸分裂時の核膜破壊 、外来性レトロウイルスと関連しており、LINE-1の核内への侵入を促進することが多いことが知られています。
今回の研究は、肝細胞株Huh7をBNT162b2にさらすと、核内のLINE-1 ORF1pが増加し,LINE-1の遺伝子発現が上昇することを明らかにしました。LINE-1の転写はクロマチン修飾、転写因子制御、RNA分解速度によって制御されていますが、BNT162b2という外的な要因に対するLINE-1活性の正確な制御については、著者らも述べていますが、さらなる研究が必要です。
研究チームは、ヒト肝細胞株を用いたin vitro試験で逆転写の証明を試みましたが、背景にはBNT162b2ワクチン接種後に自己免疫性肝炎を発症した人の症例報告 [8] があることや、 BNT162b2の毒性報告では,遺伝毒性試験や発がん性試験は行われていないことが挙げられます。
BNT162b2-mRNAは肝細胞株 Huh7で DNA に逆転写されることから、このDNAが宿主ゲノムに組み込まれ、ゲノムDNAの「完全性」に影響を与え、遺伝毒性の副作用を誘発する可能性が懸念されます。 とはいえ、現段階では、BNT162b2から逆転写されたDNAが細胞ゲノムに統合されるかどうかは証明されていません。 この論文は、mRNAの逆転写が起こりうることを示しているだけで、この逆転写されたDNAがどこにあるのかを明確にしていません。
BNT162b2のゲノムへの統合を実証するためには、BNT162b2に曝露した細胞の全ゲノム配列決定や、BNT162b2のワクチン接種を受けたヒト被験者の組織で調べるなど、さらなる研究が必要です。
本研究の実験系の限界(欠点)は、著者らも述べているように、使用した細胞モデルが、非分裂性の体細胞とは異なり、DNAの複製が活発ながん細胞であるということです。Huh7細胞は、RNA代謝に関与するタンパク質の発現が増加するなど、遺伝子やタンパク質の発現が大きく異なることが示されています。これが、通常の細胞に起きる現象として、一般化できるかという問題があります。
しかし、骨髄や上皮基底層などヒトの多くの組織や胚発生期においても細胞増殖は活発であり、そのような状況下でのBNT162b2のゲノム統合への影響も検討する必要があると著者らは述べています。さらに、LINE-1の効果的なレトロトポジションは、ヒューマンニューロンのような非分化細胞および終末分化細胞においても報告されています [9, 10]。
いずれにせよ、今回の問題提起は特異な例である、あるいは詰めの甘い研究結果であると排除するのは簡単ですが、これではいささか科学的態度に欠けます。疑問がある点については、研究者は追試すればよいわけです。
ファイザーのEMA評価報告書では、BNT162b2は脾臓、副腎のほか、卵巣と精巣において検出可能な放射活性で分布することも示されています [3]。一方、BNT162b2の胎盤移行に関するデータは、このEMA評価報告書には見られません。今回、BNT162b2のmRNAは、注射部位濃度の0.5%に相当する濃度(0.5 μg/mL)でHuh7細胞に容易に入り、LINE-1遺伝子およびタンパク質の発現変化を誘導し、6時間以内にBNT162b2の逆転写DNAが検出されることが示されました。したがって、BNT162b2の他の細胞種や組織に対する影響をin vivoおよびin vitroの両方でさらに精査することが重要と考えられます。
おわりに
ワクチン推しの国や医療専門家などは、mRNAワクチンの安全性に関連して「ワクチンは注射部位に留まる」、「体内ではすぐに消失する」、「逆転写はない」、「DNAへ組み込まれることはない」と散々強調してきました。しかし、これらに十分な科学的根拠があるとも思えず、なぜこのように言い切ることができるのか、私は常々不思議に思ってきました。
ワクチンmRNAは修飾ウリジンRNAだから逆転写されないという言説もそうです。様々な修飾アナログを使った抗ウイルス治療薬は、ポリメラーゼや逆転写酵素によってそれらが取り込まれることを利用していますから、修飾mRNAワクチンだから逆転写されないという根拠も希薄なのです。
案の定、この2年における研究で、これらの主張は次々と砕かれる結果になってきました。
ワクチンmRNA+LNPが様々な臓器に移行することは、ファイザーの薬物動態試験で明らかになっています。ワクチンmRNAと抗原タンパク質が長期間(少なくとも2ヶ月間)体内に留まることは先の論文 [11] で示されました(→ワクチンmRNAと抗原タンパクは2ヶ月間体内で持続する)。そして、今回、ワクチンmRNAが(in vitroの結果ですが)逆転写を受けることやLINE-1の発現を促進することがわかりました。
ワクチンmRNAの宿主DNAへの統合はまだ証明されていないものの、非常に気味の悪い結果です。なぜなら、いまのmRNAワクチンは従来の不可化ワクチン、組換えタンパクワクチンと比べて、比較にならない程の副作用や接種後死亡を含めた有害事象を起こしているからです。
ことは、人類の集団的生存と健康に関わることです。日本を含めて先進諸国は、mRNAワクチンの大規模接種という、ひょっとしてヤバいことをやってしまったのではないかと印象がまた強くなりました。少なくとも今までスキップしていた安全性に関わる研究や治験を促進すべきでしょう。
それにしても、以前のブログ記事でも指摘しましたが(→新型コロナウイルスのRNAがヒトのDNAに組み込まれる)、ワクチンmRNAの細胞内侵入、LINE-1発現への影響、逆転写などは誰でも思いつく課題であるし、学部・大学院学生レベルの簡単な実験技法で結果を出すこともできます。にもかかわらず、日本からこのような研究が出てこないというのは寂しい限りです。今回の論文は、ゲノムシーケンスなどでゲノム統合の有無にまで話を持っていけば迫力があったのでしょうが、まずは、in vitroでのLINE-1の発現や逆転写の事実(公表スピード)を優先したということでしょう。
2022.03.09更新
この論文 [2] が出版された後、ワクチンmRNAがゲノムDNAに取り込まれることが証明されたという主張が、インターネット、SNS上でなされるようになりました。これについて、Heath Feedbackは事実無根としています [12]。すなわち、この研究は、逆転写されたDNAが核に入ることも、そのDNAが細胞のゲノムに統合されたことも証明していないし、実験系が肝がん細胞を使って行なったin vitroのものであり、健康な細胞やヒトに外挿することはできないとしています。
引用文献
[1] Zhang, L. et al.: Reverse-transcribed SARS-CoV-2 RNA can integrateinto the genome of cultured human cells and can be expressed in patient-derived tissues. Proc. Natl. Acad. Sci. USA. 118, e2105968118 (2021). https://www.pnas.org/content/118/21/e2105968118
[2] Aldén, M. et al.: Intracellular reverse transcription of Pfizer BioNTechCOVID-19 mRNA vaccine BNT162b2 In vitro in human liver cell line. Curr. Issues Mol. Biol. 44, 1115–1126 (2022). https://www.mdpi.com/1467-3045/44/3/73
[3] Europian Medecins Agency: Assesment Report. Feburuary 19, 2021. https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf
[4] Mita, P. et al.: LINE-1protein localization and functional dynamics during the cell cycle. eLife 7, e30058 (2018). https://elifesciences.org/articles/30058
[5] Jones, R. B. et al.: LINE-1 retrotransposable element DNA accumulates in HIV-1-infected cells. J. Virol. 87, 13307–13320 (2013). https://doi.org/10.1128/JVI.02257-13
[6] Macchietto, M. G. et al.: Virus-induced transposable element expression up-regulation in human and mousehost cells. Life Sci. Alliance 3, e201900536 (2020). https://www.life-science-alliance.org/content/3/2/e201900536
[7] Yin, Y. et al.: Exogenous coronavirus interacts with endogenous retrotransposon in human cells. Front. Cell Infect. Microbiol. 11, 609160 (2021). https://doi.org/10.3389/fcimb.2021.609160
[8] Bril, F. et al.: Autoimmune hepatitis developing after coronavirus disease 2019 (COVID-19) vaccine: Causality or casualty?. J. Hepatol. 75, 222–224 (2021). https://doi.org/10.1016/j.jhep.2021.04.003
[9] Kubo, S. et al.: L1 retrotransposition in nondividing and primary human somatic cells. Proc. Natl. Acad. Sci. USA. 103, 8036–8041 (2006). https://www.pnas.org/content/103/21/8036
[10] Macia, A. et al.: Engineered LINE-1 retrotransposition in nondividing human neurons. Genome Res. 27, 335–348 (2017). https://genome.cshlp.org/content/27/3/335.long
[11] Roltgen, K. et al.: Immune imprinting, breadth of variant recognition, and germinal center responsein human SARS-CoV-2 infection and vaccination. Cell published online January 25, 2022. https://doi.org/10.1016/j.cell.2022.01.018
[12] Health Feedback: Study by Lund University researchers didn’t show that COVID-19 mRNA vaccines change our DNA. March 7, 2022.
https://healthfeedback.org/claimreview/study-lund-university-didnt-show-covid-19-mrna-vaccines-change-dna-epoch-times/
引用したブログ記事
2022年2月21日 ワクチンmRNAと抗原タンパクは2ヶ月間体内で持続する
2021年6月28日 mRNAワクチンへの疑念ー脂質ナノ粒子が卵巣に蓄積?
2021年6月4日 mRNAワクチン接種は実験的遺伝子治療?
2021年5月30日 ヒトのゲノムに組み込まれる?
2021年5月26日 SARS-CoV-2の遺伝子がヒトDNAと組み込まれることを裏付ける新たな証拠
2021年5月15日 新型コロナウイルスのRNAがヒトのDNAに組み込まれる
2020年3月31日 集団免疫とワクチンーCOVID-19抑制へ向けての潮流
カテゴリー:感染症とCOVID-19 (2022年〜)