はじめに
私は約1年半前のブログ記事で、mRNAテクノロジーを使った今のCOVID-19ワクチンは失敗ではないかと述べました(→ワクチンとしてのスパイクの設計プログラムの可否)。主な理由は二つあります。その一つはウイルスのスパイクタンパク質に特化したmRNAワクチンでは、スパイク特異的T細胞の誘発には優れているけれども、すぐにウイルスの免疫逃避の変異が起こり、ワクチンの効力が低下することです。短期間のウイルス変異の度にアッップデートしたmRNAを接種しなければならないとなると、これはワクチン戦略としてはもはや成功とは言えないでしょう。
もう一つは、生体の遺伝的なタンパク質発現の機構を利用したプロセスには未知の部分が大きく、健康体に打つには安全性の面で懸念があることです。特にウイルス変異の度に何度もmRNAを体に入れる影響については何もわかっておらず、危険を伴います。
その意味で、mRNAワクチンではなく、昔からある不活化ウイルスワクチンを使うべきだと述べました。その理由は複合的なタンパク質に応答するT細胞を誘発することで、効力は弱くても持続性の面では優れていると考えられるからです。すなわち、タンパク質上のいかなるウイルス変異にも有用なままである複数抗原ベースのワクチンであることです。不活化ワクチンは、CD8+ T細胞と比較してより強力なCD4+ Th1細胞応答を与えると考えられます。何よりも、安全性の面では、歴史的に、経験的に有利と考えられます(ただし、もちろんこれにも懸念はある [後述])。
この私の考えを支持するような論文が、最近 Cell Reports Medicine 誌に掲載されました [1]。不活化ワクチンは、多くのタンパク質に特異的なT細胞応答を誘導し、そのT細胞応答の総量はmRNAワクチンで誘導されたものと同等である、というものです。ここで、この論文の概要を紹介したいと思います。
1. T細胞
論文の紹介に入る前に、キーになるT細胞について簡単に復習したいと思います。T細胞は、表面にT細胞受容体(T cell receptor, TCR)を発現する免疫細胞(リンパ球の一種)です。一つ一つのT細胞は、特定の抗原と結合できる抗原受容体(補助受容体):T細胞受容体をもち、獲得免疫の司令塔の役割を担います。
T細胞は、抗原刺激を受けていない段階ではナイーブT細胞とよばれる状態ですが、樹状細胞、マクロファージ、B細胞などの抗原提示細胞により、エフェクターT細胞へと活性化されます。その機能と発現する抗原受容体の種類によってヘルパーT細胞(Th1、Th2、Th17)、細胞傷害性T細胞(CTL、キラーT細胞)、制御性T細胞(Treg)に分けられます。
体内にウイルスや異物が入ってくると、マクロファージや樹状細胞がそれを抗原として認識し、その情報を受け取ったヘルパーT細胞が、B細胞による特異的抗体の産出を誘導したり、細胞障害性T細胞に攻撃対象を指示したりします。この抗原情報のやり取り、活性化に介在しているのが、MHC(major histocompatibility complex)と呼ばれる糖タンパク質分子、およびMHCと結合するCD4とCD8と呼ばれる補助受容体です。MHCはクラスIとIIの2種類に分けられ、それぞれCD8およびCD4の保存領域に結合します。
マクロファージ、樹状細胞、B細胞などの免疫細胞の表面にあるのはクラスIIのMHC(MHCII)です。活性化シグナルは、T細胞受容体が認識され、MHCII分子の表面に表示される同族の抗原性ペプチドに結合すると、複数の共刺激シグナルにより伝達されます。
CD4を発現したT細胞(CD4+T細胞)はヘルパーT細胞となりますが、その一つのTh1は、樹状細胞上のMHCIIと結合してその抗原提示を認識し、サイトカイン(IFN-γ、IL-2など)を分泌することによってマクロファージ、細胞傷害性T細胞などを活性化します。もう一つのTh2は、サイトカイン(IL-4など)を分泌してB細胞を活性化し、特異的抗体の産出を誘導します。
一方、CD8を発現したT細胞(CD8+T細胞)は細胞障害性T細胞となり、樹状細胞がMHCIとともに提示する抗原を認識し、上記のようにTh1で活性化された上で、自己・非自己の識別、ウイルス感染細胞、がん細胞などの不用細胞の破壊・除去に関わります。
2. 研究の成果ー不活化ワクチンの意義
以下、当該論文 [1] の説明に入りますが、成果の主旨は以下のようになります(図1参照)。
1) 不活化コロナワクチンは、多くのタンパク質に特異的なT細胞応答を誘導する
2) T細胞応答の総量は、mRNAワクチンで誘導されたものと同等である
3) 不活化ワクチンにより誘導されたT細胞は、主にCD4+である
4) 誘導されたT細胞応答は、オミクロンの変異に耐える
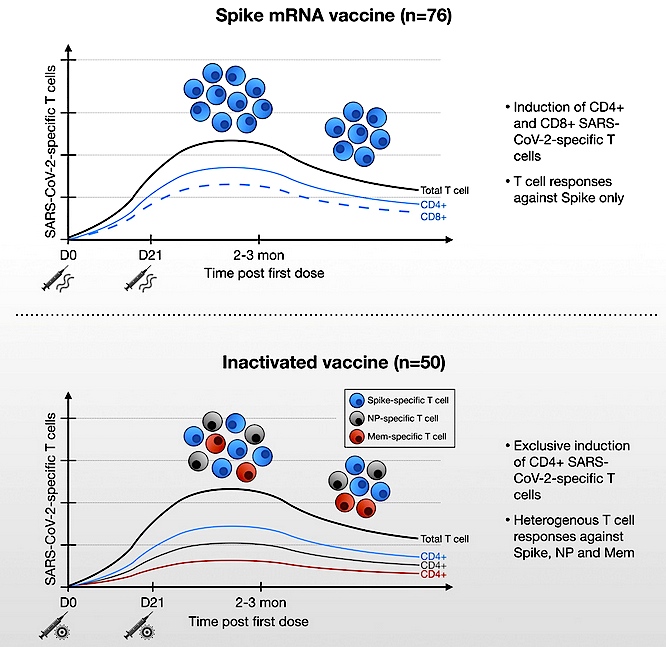
図1. mRNAワクチンによるスパイク特異的CD4+、CD8+T細胞の誘導(上)および不活化ワクチンによるヘテロなタンパク質に特異的なCD4+T細胞の誘導(下)(文献 [1] より転載).
COVID-19パンデミックは3年目に突入し、ウイルス学的状況は大きく変化してきました。すなわち、オリジナルの武漢型スパイクタンパク質に基づいて設計されたmRNAワクチンが誘発する抗体に対して、その中和能力から逃避できる新しい変異体が次々と出現し、状況が根本的に変わってきました。このことから、ワクチンの免疫原性について、中和抗体測定に基づくだけでなく、細胞免疫の評価も必要と考えられます。
T細胞は、SARS-CoV-2の感染そのものを防ぐことはできませんが、感染細胞を認識して溶解する能力を持ち、ウイルスの病原性の制御にきわめて重要である可能性があります。そこで、研究チームは、健康な成人集団(コホート)において、不活化ウイルスワクチン(BBIBP-CorVおよびCoronaVac)およびmRNA(BNT162b2)ワクチンによって誘発される、異なるSARS-CoV-2タンパク質に対する細胞性免疫について特性評価を行ないました。
T細胞は抗原に出会うとサイトカインを分泌しますが、この能力を測定する全血中サイトカイン放出試験(cytokine release assay、CRA)を実施したところ、不活化ワクチン接種者はmRNAワクチン接種者に比べて、スパイクペプチド刺激T細胞サイトカイン量が低いことがわかりました。しかし、両ワクチン(不活化ワクチンとmRNAワクチン)は、IFN-γとIL-2分泌プロファイルを持つTh1反応を同じように誘導しました。また、両ワクチンとも、スパイクのS2領域により集中する同等の優占的免疫誘発を示しました。
特徴的なことして、不活化ワクチンは、スパイクタンパク質のみに特異的な反応を誘発しないものの、mRNAワクチン接種者には明らかに存在しない、膜および核タンパク質特異的T細胞が大量に誘導されました。ワクチンで誘導されたIFN-γとIL-2のレベルの定量値に基づく多抗原ワクチン誘導T細胞応答を比較すると、不活化ワクチンはより幅広いT細胞免疫を誘導するだけでなく、T細胞応答の総量としてもmRNAワクチンと同等なレベルで誘導することが示されました。
このように、不活化ワクチンが、異なるSARS-CoV-2タンパク質に対する複合的抗原性T細胞反応を引き起こすことは重要です。なぜなら、SARS-CoV-2に感染しながら無症状の人、あるいはほとんど症状が出ない人では、多様な構造および非構造タンパク質に存在する異なるエピトープに対するT細胞反応を持っているからです。
これは、核タンパク質またはエンベロープと膜に対するワクチンを接種した非ヒト霊長類とマウスの実験でも見ることができます。これらのワクチン接種動物では、より重症化を低くする病態を示し、低いウイルス量を有していることがわかっています。つまり、不活化ワクチンは重症化予防に役立つということです。
もう一つ重要なこととして、不活化ワクチンの広域の特異性は、次々と変異するSARS-CoV-2タンパク質の影響に耐えられる可能性を示していることです。すなわち、すべてのワクチン接種者において、スパイクあるいは膜特異的T細胞応答は、オミクロンの変異によって著しく阻害されるものの、その複合的なワクチン誘導T細胞応答(スパイク、膜、核タンパク質)はオミクロンが変異したとしてもよく保存されていました。したがって、不活化ウイルス接種者における広域的応答T細胞の存在は、変異に耐えうるメモリーT細胞の集団を提供していると考えられます。
今回の研究では、CD4+およびCD8+T細胞濃縮法を用いたT細胞アッセイを実施することにより、不活化ワクチンによる強固なT細胞応答は、CD4+T細胞によってのみ媒介されることが示されました。つまり、不活化ワクチンは、いかなるウイルスタンパク質に対してもCD8+T細胞応答を誘発しないということです。対照的に、先行研究でも証明されているように、mRNAおよびアデノウイルスベクターワクチンの接種者では、CD4+およびCD8+T細胞応答を誘導できることが示されました。
これらの結果は、不活化ワクチン接種によって生じるT細胞のヘテロな特異性の利点を考える上では、臨床結果に基づいてうまく説明される必要があります。つまり、重症化発症予防におけるCD4とCD8の役割は何かということです。
一方で、不活化SARS-CoV-2ワクチンによってCD4+とCD8+の両方のT細胞応答を誘導することを示した他グループの研究もあります。このように観察された違いは、季節性コロナウイルスによって誘導された交差反応性SARS-CoV-2特異的CD8+T細胞の存在の可能性もあり、本当のSARS-CoV-2特異的ワクチン誘導T細胞の決定を混乱させる原因になっているかもしれません。 さらに、ワクチン接種を受けた人の中には、SARS-CoV-2の無症候性感染があって、SARS-CoV-2特異的CD8+T細胞を保有している可能性もあります。しかし、今回のデータと先行研究のデータとの相違を説明しうる主要な要因は、T細胞の特性解析の方法の違いにあると考えられます。
オミクロン出現前のさまざまなコホートにおける不活化ワクチンの有効性に関する臨床的分析から、重症COVID-19の発症に対して防御効果を示すものの、その効果はmRNAワクチンよりも低いことが示されました。一方、香港の最近のデータでは、オミクロン感染者の軽度および重度のCOVID-19発症に対する有効性は、3回接種後の2つのワクチンの有効性は同等でした。
不活化ワクチンにおいては、2回目の接種から3ヵ月後に3回目を接種しても、スパイク、膜、核タンパクのT細胞反応には変化がないことが示されました。3つの異なるタンパク質に対するT細胞応答の大きさは、6カ月前に一次接種を完了し、研究期間内にブースター接種をしなかった人でも同等でした。すなわち、一次完全接種の完了から2カ月後に不活化ワクチンの3回目を接種しても、中和抗体レベルはわずかに上昇しただけでした。これは、不活化SARS-CoV-2が一次接種で産生された抗体によって中和され、免疫系を刺激する抗原の利用率が低下したためであると考えられます。
結論として、不活化ワクチンは、液性免疫原性においては明らかにmRNAワクチンに劣っていますが、mRNAワクチンと同等の大きさで優れたT細胞応答を誘発し、少なくとも6ヶ月間、追加のブースター接種を必要とせずに持続することが示されました。異なるタンパク質(特に膜タンパク質と核タンパク質)を認識する能力により、不活化ワクチンによって誘導されたT細胞応答は、スパイクに特化したmRNAワクチンに比べて、オミクロンに存在する変異により抵抗性を示しました。
しかし、この複合的タンパク質特異的T細胞応答は、CD4+およびCD8+T細胞の協調的な拡大機能ではなく、CD4+T細胞の選択的なプライミングによって媒介されることが明らかになりました。この知見の臨床的意味は、今後大規模臨床試験で評価されるべきであり、それはまたSARS-CoV-2の病原性におけるウイルス特異的CD4+またはCD8+T細胞の影響を明らかにするのに役立つと考えられます。
不活化ワクチンで懸念されることの一つは、一般にワクチン候補のほとんどがそうですが、免疫系を可能な限り高めて強力な免疫を誘導することを目的としているため、接種後の過剰なT細胞応答によってサイトカインストームが誘導される可能性です [2]。したがって、COVID-19ワクチンによって惹起されるT細胞応答は、免疫病理学的ダメージを避けるためにうまくコントロールされなければなりません。
実際のワクチン接種後のサイトカインストームと思われるケースは、mRNAワクチンで報告されています [3]。ファイザーあるいはモデルナ製COVID-19ワクチンの2回目の接種後に死亡した4症例について、RNA解析を行なったところ、これらの症例では好中球の脱顆粒およびサイトカインシグナル伝達に関与する遺伝子がアップレギュレートされていました。
おわりに
上述したように、現行のスパイコードmRNAワクチンの問題は、ウイルス変異による免疫逃避と抗原タンパク質の発現プロセスにおける未知の危険性への懸念です。特に後者においては、現に様々な副作用、接種後の有害事象と死亡、後遺症などの事例があまりにも多く、これから現れるかもしれない未知も危険性もはらんでいます。
パンデミックという状況下に鑑み、緊急承認されたmRNAワクチンですが、やはり健康体への導入は早すぎたというか、やるべきではなかったという印象です。ここにきて、不活化ワクチンの意義に関する研究情報も出てきて、ワクチン推進派による相変わらずのmRNAワクチン推しとは裏腹に、科学的には一段とmRNA製剤への風当たりが強くなっている感じがします。
mRNAワクチン批判の論文は、医療専門家が好むランセットやNEJMといった権威ある医学誌にはまず掲載されず、主に新興電子ジャーナルにしか掲載されません。その意味で、今回インパクトファクターが約17というそれなりの影響があるCell Reports Medicineに不活化ワクチンの比較論文 [1] が載ったことは、大きな意味があると思います。
引用文献
[1] Lim, J. M. E. et al.: A comparative characterization of SARS-CoV-2-specific T cells induced by mRNA or inactive virus COVID-19 vaccines. Cell Rep. Med. Published online October 6, 2022, 100793. https://doi.org/10.1016/j.xcrm.2022.100793
[2] Gao, Q. et al.: Development of an inactivated vaccine candidate for SARS-CoV-2. Science 369, 77-81 (2020). https://www.science.org/doi/10.1126/science.abc1932
[3] Murata, K. et al.: Four cases of cytokine storm after COVID-19 vaccination: Case report. Front. Immunol. 13, 967226 (2022). https://doi.org/10.3389/fimmu.2022.967226
引用したブログ記事
2021年6月9日 ワクチンとしてのスパイクの設計プログラムの可否